
Trombofilia, badania genetyczne na zakrzepice Warszawa
Aktualny stan diagnostyki genetycznej trombofilii
Trombofilia inaczej nazywana nadkrzepliwością lub zakrzepicą to wrodzona (czyli genetycznie uwarunkowana) lub nabyta skłonność do choroby zakrzepowej żył, rzadziej tętnic. Zakrzepica może dotyczyć żył powierzchownych lub głębokich, zazwyczaj kończyn dolnych. Ze względu na lokalizację można ją podzielić na postać uogólnioną oraz miejscową. W patogenezie choroby kluczową role odgrywają zwolniony przepływ krwi, uszkodzenia ściany naczyń i zaburzenia równowagi między czynnikami pro- i antykoagulacyjnymi krwi. Do najważniejszych objawów zakrzepicy żył głębokich należą ból przy chodzeniu i staniu, obrzęk kończyn, zwiększone temperatura chorego regionu ciała i zaczerwienienie skóry, zasinienie miejsca chorobowego W większości przypadków objawy zakrzepicy pojawiają się nagle, w ciągu kilku dni. Nieleczona zakrzepica może doprowadzić do rozwoju choroby zakrzepowo-zatorowej, która jest stanem bezpośredniego zagrożenia życia. Dlatego tak ważne znaczenie ma diagnostyka zakrzepicy, zwłaszcza, że w wielu przypadkach choroba ta może rozwijać się przez długi czas bez żadnych widocznych objawów. Prawidłowe rozpoznanie choroby zakrzepowej i wdrożenie odpowiedniego leczenia poprawia rokowanie, zmniejszając ryzyko wystąpienia choroby zatorowej i jej powikłań.
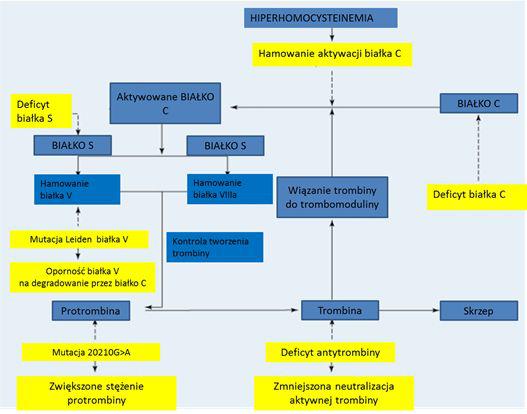
Zakrzepica określana także mianem trombofilii jest wynikiem zaburzenia procesów hemostazy – złożonego układu reakcji enzymatycznych (Rys.1). Skrzep i fibryna powstają „na żądanie” organizmu na drodze skomplikowanej, wieloetapowej kaskady przemian biologicznych. W tej tzw. kaskadzie krzepnięcia bierze udział kilkanaście różnych białek zwanych czynnikami krzepnięcia. Są to głównie białka znajdujące się w osoczu krwi oraz białko zawarte w błonach komórek – czynnik tkankowy. Najczęstszą przyczyną trombofilii wrodzonej u osób rasy białej jest tzw. czynnik V Leiden – mutacja p.R506Q w genie F5 kodującym czynnik V szlaku protrombinowego [3]. Rzadziej występujące formy wrodzone, które są rozpoznawane podczas diagnostyki i badań laboratoryjnych, to zakrzepica związana z mutacjami w innych genach kodujących białka powodujące niedobór antytrombiny, niedobór białka C, białka S. Wśród trombofilii nabytych wyróżniamy zespół antyfosfolipidowy, hiperhomocysteinemię, zwiększone stężenie czynnika IX lub XI. Średni wiek pojawienia się objawów zakrzepicy w większości przypadków wynosi 45 lat. Coraz więcej uwagi poświęca się jednak trombofiliom występującym u dzieci. Jak wskazuje diagnostyka, zazwyczaj są one powikłaniem choroby podstawowej, zabiegów chirurgicznych, stosowania centralnych wkłuć. Uważa się, iż do powstania zakrzepicy konieczne jest współistnienie kilku czynników ryzyka, np. nakładanie się na wrodzoną predyspozycję do trombofilii nabytych czynników ryzyka, takich jak zabieg operacyjny, ciąża lub przyjmowanie doustnych leków antykoncepcyjnych [4].
Rys. 1. Schemat kaskady tworzenia skrzepu. Niebieskie pola i ciągłe strzałki – składowe kaskady tworzenia skrzepu w warunkach fizjologicznych, żółte pola i strzałki przerywanie – sytuacja patologiczna.
Badania diagnostyczne
|
Nazwa genu |
Białko kodowane przez gen |
Zakres badania |
|
F5 |
czynnik V |
p.R506Q, tradycyjna nazwa: mutacja Leiden |
|
F2 |
protrombina |
c.20210G>A |
|
HABP2 |
białko wiążące kwas hialuronowy, inaczej proteaza aktywujaca czynnik VII |
p.G534E (rs7080536), tradycyjna nazwa: wariant Marburg I |
|
MTHFR |
reduktaza 5,10- metylenotetrahydrofolianu |
p.A222V (c.C677T, rs1801133), p.E492K |
|
PROC |
białko C |
brak mutacji typu hot spot, badanie powinno obejmować cały gen |
|
PROS1 |
białko S |
brak mutacji typu hot spot, badanie powinno obejmować cały gen |
|
SERPINC1 |
antytrombina III |
dwie najczęstsze zmiany to: p.R47C (rs121909547) i p.A384P (rs121909548) |
|
THBD |
trombomodulina |
brak mutacji typu hot spot, badanie powinno obejmować cały gen |
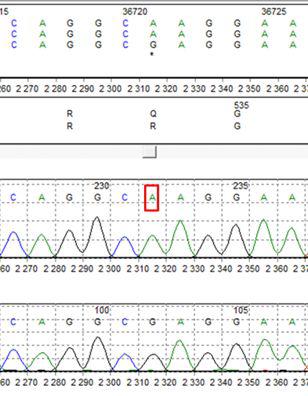
W diagnostyce zakrzepicy najwyższą czułością charakteryzują się badania laboratoryjne z zastosowaniem metody sekwencjonowania DNA. Pozwalają one na wykrycie – oprócz częstych mutacji – również zmian rzadkich, często nieopisanych jeszcze w literaturze medycznej. (Rys.2.)
Rys. 2. Identyfikacja mutacji R506Q (Leiden) w genie F5.
Górna sekwencja – obecność mutacji w obu kopiach genu (tzw. homozygota), dolna sekwencja – sekwencja prawidłowa (bez mutacji Leiden). Czerwonym prostokątem zaznaczono nukleotyd, który uległ zamianie w wyniku mutacji.
Mutacja Leiden
Mutacja Leiden to defekt genetyczny polegający na zamianie aminokwasu argininy w pozycji 506 łańcucha peptydowego w glutaminę. Nieprawidłowość ta może zostać wychwycona dzięki badaniom laboratoryjnym na zakrzepicę, które wykonujemy w naszej poradni genetycznej w Warszawie. Tradycyjna nazwa Leiden pochodzi od nazwy miasta w Holandii i została nadana przez odkrywcę mutacji – prof. Rogiera Bertina w 1994r [3]. Czynnik V Leiden występuje u około 5% rasy białej i jest związany z 3-7 krotnie zwiększonym ryzykiem żylnej zakrzepicy (Tabela 3) [7]. Białko V z mutacją Leiden jest niewrażliwe na proteolityczne działanie białka C, upośledzając w ten sposób hemostazę i powodując zwiększenie ryzyka powstania zmian zakrzepowo-zatorowych w organizmie (Rys. 1). Predyspozycja do trombofilii związana z mutacją Leiden jest dziedziczona w sposób dominujący. Oznacza to, że osoba posiadająca mutację już w jednej kopii genu (tzw. heterozygota) ma podwyższone ryzyko trombofilii, ryzyko to jest jeszcze wyższe u osób będących homozygotami, tj. posiadającymi mutację w obu kopiach genu F5. Heterozygoty dla mutacji Leiden mają 2-3 krotnie podwyższone ryzyko utraty ciąży i wystąpienia innych komplikacji w trakcie ciąży (np. stany rzucawkowe, hipotrofia płodu, przedwczesne odklejenie łożyska), dlatego tak ważna jest diagnostyka zakrzepicy u kobiet, które planują potomstwo. Kliniczna ekspresja trombofilii związanej z mutacją Leiden zależy od wielu czynników: (1) obecności mutacji w jednej lub w obu kopiach genu F5 (heterozygoty mają nieco zwiększone ryzyko zakrzepicy żylnej w stosunku do populacji ogólnej; homozygoty mają o wiele większe ryzyko zakrzepicy), (2) współistnienia innych wariantów genetycznych kojarzonych z trombofilią, które mają dodatkowy wpływ na ogólne ryzyko zakrzepowe, (3) nabytych zakrzepowych zaburzeń: przeciwciała antyfosfolipidowe, hiperhomocysteinemia, wysoki poziom czynnika VIII, choroba nowotworowa, (4) czynników środowiskowych: podróży, palenie papierosów, centralnych cewnikchów żylny, ciąży, doustnych środków antykoncepcyjnych, hormonalnej terapii zastępczej, selektywnych modulatorów receptora estrogenowego, przeszczepów narządów, wieku i zabiegów chirurgicznych [8].
|
Pacjent |
Ryzyko zakrzepicy żył |
|
Przeciętna osoba rasy białej |
1 |
|
Osoba stosująca antykoncepcję hormonalną |
4 |
|
Heterozygota dla mutacji Leiden |
5 - 7 |
|
Heterozygota dla mutacji Leiden stosująca antykoncepcję hormonalną |
30 - 35 |
|
Homozygota dla mutacji Leiden |
80 |
|
Homozygota dla mutacji Leiden stosująca antykoncepcję hormonalną |
??? >100 |
|
Heterozygota dla wariantu protrombiny |
3 |
|
Homozygota dla wariantu protrombiny |
???, ryzyko rozwoju zakrzepicy tętniczej |
|
Heterozygota dla wariantu protrombiny stosująca antykoncepcję hormonalną |
16 |
|
Heterozygota dla deficytu białka C |
7 |
|
Homozygota dla deficytu białka C |
ciężka zakrzepica od urodzenia |
|
Heterozygota dla deficytu białka S |
6 |
|
Homozygota dla deficytu białka S |
ciężka zakrzepica od urodzenia |
|
Heterozygota dla deficytu antytrombiny |
5 |
|
Homozygota dla deficytu antytrombiny |
letalna postać |
|
Hiperhomocysteinemia |
2 - 4 |
|
Hiperhomocysteinemia+heterozygote dla mutacji Leiden |
20 |
Heterozygota – osoba posiadająca mutację w jednej kopii genu, homozygota – osoba posiadająca mutację w obu kopiach genu. Każda osoba posiada po dwie kopie genów znajdujących się na chromosomach autosomalnych: jedną odziedziczoną od matki, drugą od ojca.
Protrombina
W poradni genetycznej MEDGEN w Warszawie zajmujemy się także specjalistyczną diagnostyką zakrzepicy mającą ścisły związek z protrombiną. Trombofilia związana z protrombiną charakteryzuje się objawami żylno-zakrzepowej choroby zatorowej, głównie u dorosłych jako zakrzepica żył głębokich kończyn dolnych lub zatorowość płucna. Kliniczne objawy tego typu trombofilii są różne: wiele osób będących heterozygotami lub homozygotami wariantu c.20210G>A nigdy nie rozwija trombofilii, większość heterozygot, które rozwijają chorobę, pozostaje asymptomatyczna aż do wieku dorosłego, niektórzy natomiast rozwijają objawy choroby już przed 30 r.ż. Relatywne ryzyko rozwoju choroby w wieku dorosłym u heterozygot c.20210G>A jest 2-5-krotnie wyższe niż u osób bez mutacji [9].
Pomimo że diagnostyka wskazuje, iż trombofilia związana z obecnością wariantu c.20210G>A genu F2 ma udowodniony wpływ na zwiększone ryzyko utraty ciąży, to związek ze stanami rzucawkowymi i innymi komplikacjami w czasie ciąży (np.hipotrofą wewnątrzmaciczną płodu, odklejenie łożyska) pozostają na etapie kontrowersji. Uważa się obecnie, że doustna antykoncepcja hormonalna oraz długa podróż są zewnętrznymi czynnikami zwiększającymi ryzyko zakrzepicy u heterozygot lub homozygot dla wariantu c.20210G>A. Trombofila związana w wariantem protrombinowym jest dziedziczona w sposób dominujący [10].
Gen MTHFR
Mutacja p.A222V (inna nazwa c.677C>T) w układzie heterozygotycznym (w jednej kopii genu) lub w układzie homozygotycznym (w obu kopiach genu) jest odpowiedzialna za zmniejszenie aktywności enzymatycznej białka. Mutacja w genie MTHFR prowadzi do niestabilności enzymu kodowanego przez gen MTHFR oraz do zmniejszenia aktywności remetylacji homocysteiny. Szansę na wykrycie tego typu mutacji dają specjalistyczne badania laboratoryjne na zakrzepicę. U homozygot dla mutacji c. 677C>T stwierdza się predyspozycję do łagodnej hiperhomocystynemii [11]. W populacji ogólnej homozygotami dla tego wariantu genetycznego jest około 10%-20% osób.
Trombofilia a poronienia
Szacuje się, że 15% wszystkich klinicznie rozpoznanych ciąż kończy się poronieniami. Nawracające poronienia dotyczącą 0.4–2% par. Organizacja European Society for Human Reproduction and Embryology (ESHRE) definiuje nawracające poronienia jako trzy lub więcej utraty ciąż, które miały miejsce przed 20. tygodniem ciąży. Inne źródła podają jako granicę dwa poronienia (np. Rekomendacje Polskiego Towarzystwa Ginekologicznego w zakresie wybranych patologii wczesnej ciaży oraz postępowania w ciąży po zapłodnieniu in vitro).
Ustalenie czynników ryzyka nawracających poronień obejmuje anatomiczne, hormonalne, immunologiczne badania, analizę aberracji chromosomowych oraz laboratoryjne badania biochemiczne i genetyczne w kierunku trombofilii. Zarówno wrodzona (dziedziczna) postać trombofilii, jak i nabyta zwiększają ryzyko utraty ciąży. W literaturze medycznej najwięcej danych znaleźć można dla zespołu antyfosfolipidowego (APS). Wyniki zakrojonego na dużą skalę badania klinicznego prowadzonego przez The Ni^mes Obstetricians and Haematologists (NOHA) wykazały silną korelację między utratą ciąży o niewyjaśnionej etiologii i obecnością mutacji genu protrombiny i czynnika V w układzie heterozygotycznym [12].
Badanie genetyczne – dla kogo?
Istnieją ścisłe kryteria mówiące, kto powinien wykonać badania w kierunku wrodzonych trombofilii (Tabela 1). Bezsprzeczne są korzyści, jakie płyną z ustalenia ryzyka rozwoju zakrzepicy również u bezobjawowych osób z obciążonym wywiadem rodzinnym. Wynik badania genetycznego może mieć szczególne znaczenie przed podjęciem decyzji o włączeniu antykoncepcji hormonalnej, ciąży. Osoby, u których na skutek przeprowadzonej diagnostyki zakrzepicy zostanie wykryta mutacja, powinny zdawać sobie sprawę z objawów choroby zakrzepowej, które wymagają natychmiastowej pomocy medycznej i potencjalnej konieczności stosowania profilaktyki przeciwzakrzepowej.
Literatura:
-
JA. Heit. Thrombophilia: common questions on laboratory assessment and management.„Hematology Am Soc Hematol Educ Program”, s. 127-35, 2007.
-
Chong LY, Fenu E, Stansby G, Hodgkinson S; Guideline Development Group. Management of venous thromboembolic diseases and the role of thrombophilia testing: summary of NICE guidance. BMJ. 2012 Jun 27;344:e3979. doi: 10.1136/bmj.e3979.
-
Bertina RM, Koeleman BP, Koster T, Rosendaal FR, Dirven RJ, de Ronde H, van der Velden PA, Reitsma PH. Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature. 1994 May 5;369(6475):64-7.
-
Ehrenforth S, Nemes L, Mannhalter C, Rosendaal FR, Koder S, Zoghlami-Rintelen C, Scharrer I, Pabinger I. Impact of environmental and hereditary risk factors on the clinical manifestation of thrombophilia in homozygous carriers of factor V:G1691A. J Thromb Haemost. 2004;2:430–6.
-
5.Duhl AJ, Paidas MJ, Ural SH, Branch W, Casele H, Cox-Gill J, Hamersley SL, Hyers TM, Katz V, Kuhlmann R, Nutescu EA, Thorp JA, Zehnder JL. Pregnancy and Thrombosis Working Group; Antithrombotic therapy and pregnancy: consensus report and recommendations for prevention and treatment of venous thromboembolism and adverse pregnancy outcomes. Am J Obstet Gynecol. 2007;197:457.
-
6. Bates SM, Greer IA, Pabinger I, Sofaer S, Hirsh J. American College of Chest Physicians; Venous thromboembolism, thrombophilia, antithrombotic therapy, and pregnancy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008;133:844S–86S.
-
Dentali F, Crowther M, Ageno W. Thrombophilic abnormalities, oral contraceptives, and risk of cerebral vein thrombosis: a meta-analysis. Blood. 2006;107:2766–73.
-
Ehrenforth S, Nemes L, Mannhalter C, Rosendaal FR, Koder S, Zoghlami-Rintelen C, Scharrer I, Pabinger I. Impact of environmental and hereditary risk factors on the clinical manifestation of thrombophilia in homozygous carriers of factor V:G1691A. J Thromb Haemost. 2004;2:430–6.
-
Lancellotti, S., De Cristofaro, R.Congenital prothrombin deficiency.Semin. Thromb. Hemost. 35: 367-381, 2009.
-
De Stefano V, Martinelli I, Mannucci PM, Paciaroni K, Chiusolo P, Casorelli I, Rossi E, Leone G. The risk of recurrent deep venous thrombosis among heterozygous carriers of both factor V Leiden and the G20210A prothrombin mutation. N Engl J Med. 1999;341:801–6.
-
Talmon, T., Scharf, J., Mayer, E., Lanir, N., Miller, B., Brenner, B.Retinal arterial occlusion in a child with factor V Leiden and thermolabile methylene tetrahydrofolate reductase mutations.Am. J. Ophthal. 124: 689-691, 1997
-
More on: factor V Leiden and prothrombin G20210A polymorphisms as risk factors for miscarriage during a first-intended pregnancy: the matched case-control 'NOHA first' study. Grandone E, Colaizzo D, Tiscia G, Margaglione M. J Thromb Haemost. 2006 Mar;4(3):709-10.


